・水は不均等に電子を共有しているため、極性分子です。
・水分子には、1つの酸素(負電荷)と2つの水素原子(正電荷)があります。
・原子の電気陰性度とその空間的配置の違いにより、水が極性になります。
「極性」という用語は、電気や磁気でよく使用されます。化学では、分子、原子、または化学基の周りの電荷の配列を指します。
水が極性か非極性かを知るには、まず極性分子と非極性分子という2つの重要な分子グループを理解する必要があります。世界のほとんどの分子にはある程度の極性がありますが、一部の分子は完全に極性または非極性です。
極性分子
2つの原子が共有結合で電子を均等に共有しないと、極性分子が発生します。分子の一部は小さな負電荷を持ち、他の部分は小さな正電荷を持ちます。
原子の電気陰性度が異なると、極性分子が形成されます。各原子には特定の電気陰性度があり、化学反応で電子を獲得して負イオンを形成する能力を定義します。
原子の電気陰性度の差が小さいと、極性共有結合が生じますが、大きな差はイオン結合を形成します。つまり、1つの原子がより多くの電子を引き付けると極性共有結合が形成され、一方、電気陰性度の大きい原子が別の原子から電子を奪い取り、まったく共有しないとイオン結合が形成されます。
そのため、極性は分子の電極の差を表します。アンモニア(NH3)、硫化水素(H2S)、二酸化硫黄(SO2)は、極性分子の例です。
無極性分子
無極性分子は、原子が共有結合で電子を等しく共有し、分子全体にゼロ電荷がある場合に形成されます。無極性共有結合の電子は均等に広がります。
これは同じまたは類似した電気陰性度を持つ2つの原子が、結合を形成するときに起こります。無極性分子は、それらの原子が電荷を互いに打ち消すように配置された極性結合を共有している場合にも形成されます。
二酸化炭素(CO2)、メタン(CH4)、ベンゼン(C6H6)は、非極性分子の最も一般的な例の一部です。
分子の極性を知る方法
分子が極性か非極性かを予測する簡単な方法があります。 周期表で電気陰性度を調べる必要があります。
2つの原子の電気陰性度の差が2.0を超える場合、原子はイオン結合を形成し、イオン分子は非常に極性が高くなります。差が0.5と2.0の間にある場合、分子はかなり極性があります。
原子の電気陰性度の差が0.5未満の場合、原子は非極性結合を形成します。 同一の原子のみが完全に非極性の分子を形成します。
元の質問に戻りましょう。水は極性でしょうか、それとも無極性でしょうか? 水(H2O)は、不均等に電子を共有しているため、極性分子です。
水はなぜ極性分子なのしょう?
水の分子は、1つの酸素と2つの水素原子で構成されています。酸素は非常に電気陰性度の高い原子であるため、電子のペア(2つの水素原子から)を自身に向かって引き寄せ、微小な負電荷を獲得します。一方、水素は部分的に正電荷を獲得します。
酸素と水素の電気陰性値は、それぞれ3.44と2.20です。
ただし、これは分子の極性を決定する唯一の要因ではありません。もう1つの主な要因は、原子の空間的な配置です。つまり、分子内の原子が中心原子の周りにどうように配置されるのかということです。
この概念を理解するために、二酸化炭素の構造式を見てみましょう。

二酸化炭素は、それぞれ炭素から180度の角度で位置する、2つの等しい電気陰性の酸素原子から成りたっています。炭素から反対方向に等しい力で電子を引き寄せるため、炭素の密度は影響を受けません。
分子の両端はわずかに負の電荷を持ち、中央の炭素原子はわずかに正の電荷を持ち、二酸化炭素分子を無極性にしています。
それでは、水分子を見てみましょう。
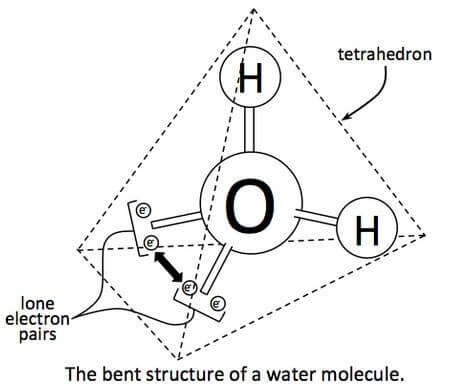
水分子では、酸素は各水素原子と電子を共有しています。酸素原子は最外殻に6個の電子を持っている、4個は結合していないままです。これらの結合電子対と非結合電子対は、四面体構造で再配列します。
酸素の電気陰性度は水素の電気陰性度よりも大きいため、電子を引き寄せます。したがって、酸素の周囲の領域は、2つの水素原子の周囲の領域に比べて負になります。これにより、水が極性分子になっています。
注:水中の酸素と水素間の共有結合は両方とも極性ですが、分子全体は電気的に中性です。すべての水分子には10個の電子と10個の陽子が含まれており、正味の電荷量はゼロです。
水の極性は特殊な化合物です
水は極性分子であるため、他の極性分子およびイオンと静電相互作用(電荷に基づく引力)を形成できます。また、水は溶質の負または正の電荷に引き付けられるため、極性溶媒として機能します。これは物質を溶解する、驚くべき能力を持っていることを意味します。

異なる水分子間の一時的な水素結合は、興味深い特性を与えています。多くの熱エネルギーを蓄えたり、高い熱容量をもつことができます。
水を加熱するには多くのエネルギーを必要としますが、多くの液体化合物よりも長時間、暖かさが持続します。これにより、水は太陽光をほとんど受けない地域に熱を運ぶため、地球での生活が可能になります。
強力な結合力と優れた溶解能力に加えて、水には独自の密度特性もあります。凍結すると、水分子はさらに離れますが、水素結合を介して互いに強く結合します。
温度が下がると水の密度は増加しますが、それも4°Cまでです。これより下では、密度が低下し、温度が0°Cに達すると、液体の水よりも軽くなります。これが氷が水に浮かぶ理由です。(海洋生物を支えています)